背景介绍
疫苗是将病原微生物(如细菌、病毒等)及其代谢产物,经过人工减毒、灭活或利用基因工程等方法制成的用于预防传染病的自动免疫制剂。自1798年英国医生琴纳研发全球最早的牛痘疫苗以来,疫苗作为预防性药物,在患病之前给予人体抵御疾病的能力,比治疗性药物意义更加重大。早期疫苗大多预防的是严重的、流行度高的传染性疾病,例如牛痘疫苗预防的天花曾经在1900-1908年间在全球杀死5亿人,十四世纪的鼠疫曾经导致欧洲三分之一的人口死亡。疫苗的出现,终结了这种毁灭性的灾难,将人类从生存威胁中解放出来,功不可没。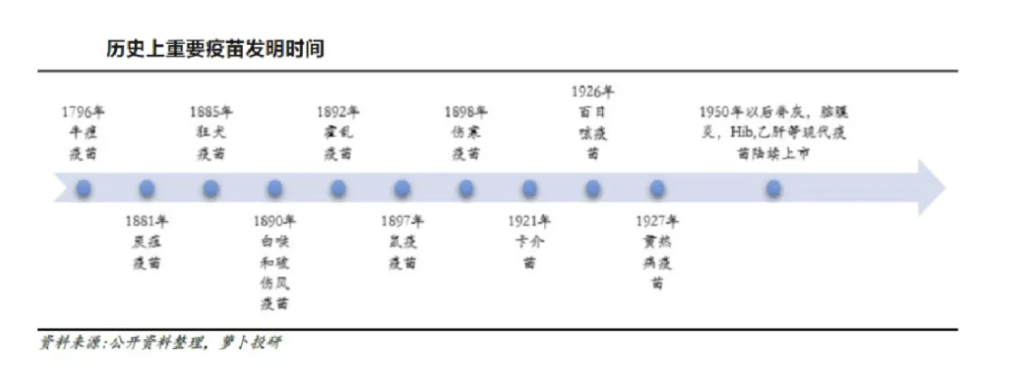
根据Statista统计数据,2023年中国疫苗市场(不含新冠病毒疫苗)规模为1017.7亿元,其中非免疫规划疫苗市场规模973.6亿元,在疫苗市场占比95.67%;免疫规划疫苗市场规模44.1亿元,占比4.33%。这意味着疫苗市场规模迈入千亿门槛,已超越不少传统大适应证治疗用药的市场规模。
疫苗的种类多样,分类方法也有多种。按国家标准,可以分为一类疫苗(免疫规划疫苗,政府免费提供并且公民必须接种,如乙肝疫苗、卡介苗等))和二类疫苗(非免疫规划疫苗,公民自愿接种且费用自行承担,如HPV疫苗、流感疫苗等)。按照制备工艺,可以分为减毒活疫苗、灭活疫苗、类毒素疫苗、多糖疫苗、多糖蛋白(结合)疫苗、重组蛋白疫苗、核酸疫苗和病毒载体疫苗等。
疫苗从早期研发到获批上市需要经历多个阶段,每个阶段都存在极其复杂的不确定性,需要对其中多个关键点进行严格的质量控制,从而确保最终产品的安全性和有效性。

支原体检测
相较于传统化学药物,以基因治疗、细胞治疗或组织工程为基础的新型生物治疗业已成为前沿性治疗药物。这些药物大多以细胞为载体制备或构建,因此,在此过程中,对于细胞种子库、病毒培养和收获、临床治疗用途的细胞等生物制品中生产制备过程易受到支原体污染。
支原体是一种比较常见但通常难以去除的污染类型,对于涉及细胞培养的生物制品工艺过程,法规要求“必须确保无支原体污染”。目前国内外药典推荐的支原体检测方法主要是基于培养法、NAT(核酸扩增法)法、细胞培养指示法。
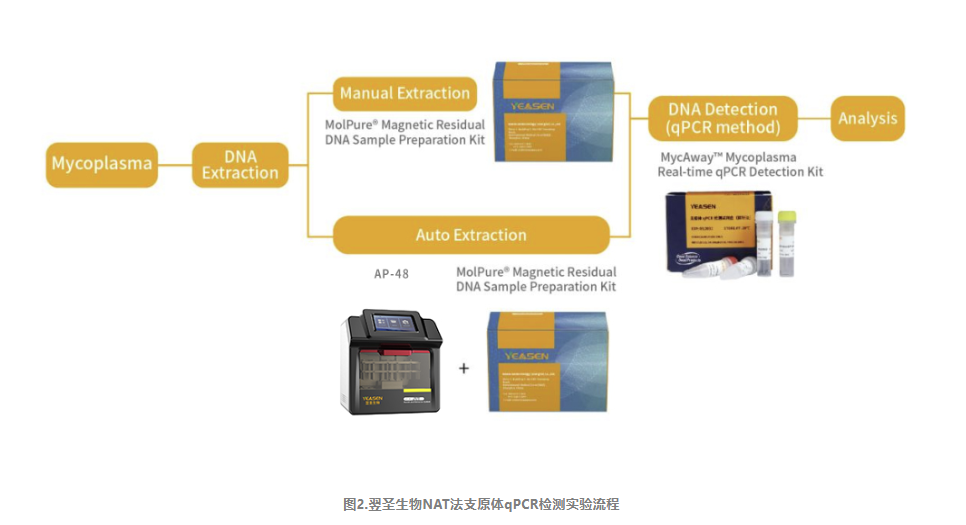
翌圣生物MycAway®支原体qPCR检测试剂盒(探针法)(2G)是基于NAT法的一种快速定性检测生产原料、细胞库、病毒种子、病毒或细胞收获液、治疗用细胞中潜在支原体污染的产品。该试剂盒基于定量PCR技术,使用Taqman荧光探针定性检测待测样本中支原体DNA,可覆盖183种支原体DNA序列;并且严格按照EP 2.6.7和JP G3支原体检测相关指南和要求进行验证,具备灵敏度高、特异性好、安全性好等特点。该试剂盒还能够与MolPure®磁珠法残留DNA样本前处理试剂盒搭配使用,通过手动提取或者使用自动化核酸提取仪自动提取样本核酸,再由qPCR收集探针的荧光信号,从而对检测结果进行判定。
宿主细胞残留DNA(HCD)检测
去除宿主细胞杂质是细胞基因治疗药物在内的生物制药产品生产中的关键步骤,其中宿主细胞残留DNA由于可能存在的免疫原性、感染性以及致瘤性等安全问题成为关键质控指标。在此情况下,建立合适的检测方法监测生产工艺,控制宿主细胞残留核酸限度,以确保产品的安全性和质量已经成为监管机构和行业内关注的重点。
§ 《中国药典》2020年版三部规定,以细胞基质生产的生物制剂外源宿主细胞DNA残留量不能超过100pg/剂,以细菌或真菌基质(酵母、大肠杆菌等)表达的生物制品中DNA残留量不超过10ng/剂;
§ 《欧洲药典》(EP10.0)通则规定的生物制品残留DNA限度大多为不超过10ng/剂;
§ 美国食品药品监督管理局(FDA)发布的指导原则中指出生物制品宿主细胞DNA残留限度不得超过100pg/剂,对于大剂量的生物制品(如单克隆抗体),根据其残留DNA来源及给药途径,DNA残留量可放宽至10ng/剂。
此外,《中华人民共和国药典》2020年版第三部规定,外源性DNA残留检测采用DNA探针杂交法、荧光染色法和定量PCR法。目前市场上对宿主细胞残留DNA检测,主要采用荧光探针qPCR方法,qPCR法具有极高的灵敏度、序列特异性和准确性,可为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段,现也已成为各生物制品厂家首选检测方法。
翌圣生物自主研发的CHO宿主细胞残留DNA的qPCR法检测试剂盒,可快速高效检测生物药中宿主DNA残留量。

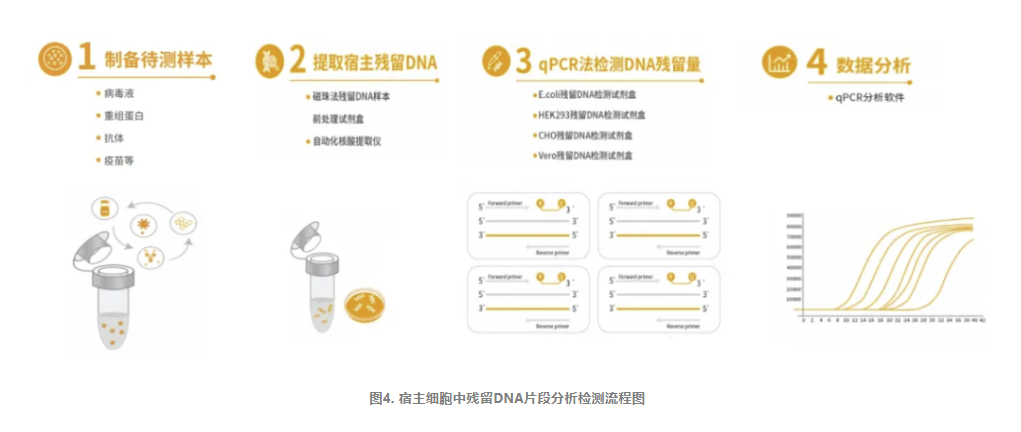
宿主细胞残留DNA片段分析
除需对DNA的残留量进行控制外,DNA残留片段大小分布也是确定其相关风险因素的重要指标。有研究表明,一个功能基因至少在200bp以上,因此大于200bp可能会有一定的致病性,且残留DNA片段越大,生物制品的风险等级越高。
美国FDA在《Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs)》的行业指南中建议将非致瘤性连续细胞的残留DNA量限制在10 ng/剂以下,DNA大小限制在约200bp以下。
2022年5月,国家药品监督管理局药品评审中心(CDE)发布的体内基因治疗产品要学研究与评价技术指导原则(试行)中也明确指出需对DNA残留量和残留片段大小进行控制,建议尽量将DNA残留片段的大小控制在200bp以下。
目前,行业内对于残留宿主细胞DNA片段分析,主要是利用毛细管电泳的方法。研究者们开发了一种基于毛细管凝胶电泳与敏感激光诱导荧光(CGE-LIF)检测残留DNA分子大小的方法,可以检测生物制品中残留DNA的大小,实验表明,大多数宿主细胞残留DNA片段大小为50~2 000bp。除了毛细管电泳法外,实时荧光定量PCR(qPCR)法也被用于进行生物制品中生产用细胞相关的DNA片段分布的分析。且qPCR法相比于CGE-LIF操作更简单,耗时更短。
针对上述情况,翌圣生物自主研发了CHO&Vero残留DNA片段分析试剂盒,采用荧光探针qPCR法原理,设计了四种不同的扩增片段(几十bp、100多bp、200多bp、500多bp),用于定量检测样本中宿主细胞残留DNA片段的大小分布情况。
宿主细胞残留蛋白(HCP)检测
生物制品中HCP残留含量通常被认为是产品的关键质量属性(CQA),是工艺稳健性监测的重要评价指标,也是产品的重要质控指标。各国法规都有涉及HCP的论述,要求必须对生物药品进行分析和纯化,以将宿主细胞蛋白HCP降低到可接受的水平。
《中国药典》三部(2020版)各论中显示,HCP标准为占总蛋白含量要小于0.05%(相当于小于500ppm)。
.美国药典USP<1132>章节规定:用一种灵敏度较高的方法检测药品中的HCP,其含量应该低于检测限(通常小于100ppm,即1mg总蛋白中HCP含量应小于100ng,也即<0.01%)。
.欧洲药典EP 2.6.34中规定:在生物制品中,HCP的含量应当小于0.1%。
.国际人用药品注册技术协调会(ICH)指南:ICH Q6B指出,需要根据ICH准则采用敏感且经过验证的有效方法来监控残留的HCP,其残留量通常要求小于100ppm。
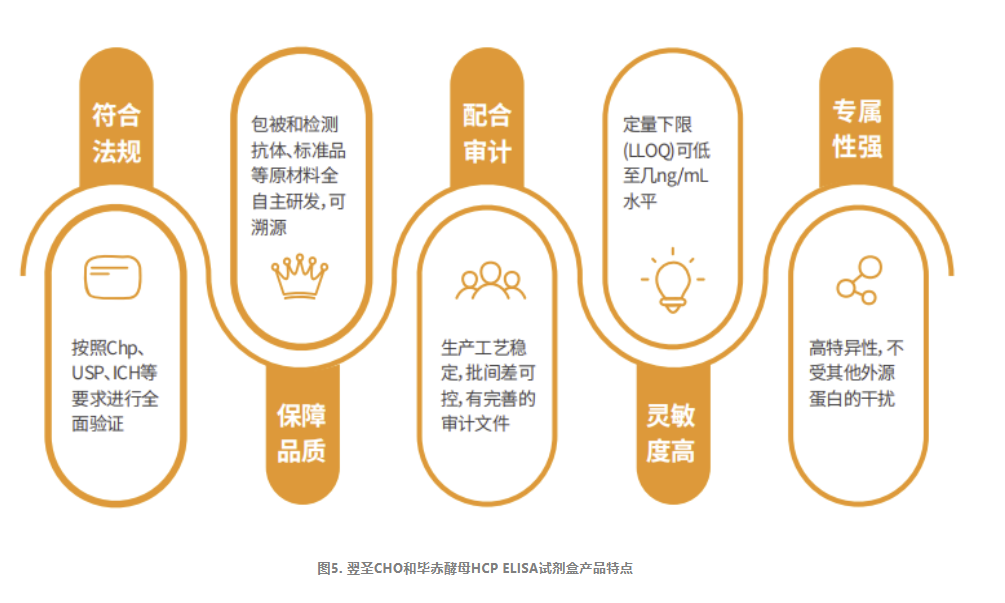
· 酶联免疫吸附法(ELISA)是目前HCP检测最常用的方法,在2020版《中国药典》通则3412/3413/3414中提到的宿主蛋白残留检测方法均为ELISA法。
翌圣生物科技(上海)股份有限公司自主研发了包括CHO和毕赤酵母宿主细胞在内的多款HCP蛋白残留量检测试剂盒。试剂盒均采用双抗夹心酶联免疫检测(ELISA)的实验原理,以及生物素-链霉亲和素放大系统,能够高灵敏的检测样本中HCP残留量。试剂盒可以用于生物制品纯化工艺过程的优化、中间工艺过程的杂质控制以及终产品的放行检测。
牛血清白蛋白(BSA)残留检测
生物制品生产中经常会涉及到细胞培养或组织培养,在这些培养中胎牛血清被广泛应用,为细胞生长提供必须的营养成分,而胎牛血清中就包含了一定量的BSA(Bovine serum albumin,牛血清白蛋白)。考虑到生产的药物的安全性,目前疫苗、抗体药物、组织工程产品以及细胞&GCT等生物制品的生产过程中,逐渐使用无血清培养基来替代含血清培养基,从而减少可能由血清带来的病毒污染等潜在危害。其中,无血清培养基多采用各种可以替代血清功能的生物大分子配制而成,例如牛血清白蛋白(BSA)、转铁蛋白和胰岛素。由此,无论使用含血清培养基还是无血清培养基,都会有BSA。虽然在生产中经过纯化等步骤去除了大部分的杂质蛋白,但仍然会有微量的外源蛋白(如BSA等)存在于最终的生物制品中。
BSA作为外源蛋白进入人体后可能引起严重过敏反应,从而影响生物制品的安全性。2020版《中国药典》(三部)对各种疫苗中BSA的残留量进行了明确规定,基本是不高于50 ng/mL或者不高于50 ng/剂。
翌圣生物依托相关法规,从市场需求出发,自主研发了牛血清白蛋白(BSA)残留量检测试剂盒。试剂盒采用双抗夹心酶联免疫检测(ELISA)的实验原理,以及辣根过氧化物酶(HRP)信号放大系统,能够高灵敏的检测样本中牛血清白蛋白残留量。试剂盒可以用于生物制品纯化工艺过程的优化、中间工艺过程的杂质控制以及终产品的放行检测。
表1. 翌圣BSA ELISA试剂盒产品性能参数
|
项目 |
参数性能 |
|
实验原理 |
双抗夹心ELISA法 |
|
信号放大 |
抗体+抗原+抗体-HRP复合物(两步法) |
|
检测波长 |
450nm和630nm |
|
实验时长 |
<3 h |
|
检测范围 |
1.5625~50ng/mL |
|
标准品溯源 |
溯源至国家标准品 |
|
准确性 |
样本加标回收率80%~120% |
|
精密度 |
批内重复性CV<10%,批间差CV<15% |
|
灵敏度 |
定量下限(LLOQ)1.5ng/mL,检测下限(LLOD)可低至0.5ng/mL |
|
适用机型 |
Molecular Devices:M和i系列 |
|
应用 |
检测疫苗、抗体药物、组织工程产品以及细胞基因治疗药物等生产过程中的BSA残留量 |
亲和配基(Protein A)残留检测
金黄色葡萄球菌细胞壁中的A蛋白(Staphylococal ProteinA,SPA)又称Protein A,是一种金黄色葡萄球菌细胞壁蛋白质,42kDa,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合,通常在大规模抗体制备中用于纯化IgG。在抗体药生产中,下游亲和层析过程中Protein A会不可避免的与目标抗体蛋白一起被洗脱下来,从而在最终纯化步骤中产生Protein A残留。这种杂质会严重影响产品质量、药效以及安全性。因此,国内外法规对残留Protein A检测以及残留量标准均有相关文件出台。
《中华人民共和国药典》2020年版第三部《人用重组单克隆抗体制品总论》3.2.4 工艺相关杂质中提出“采用适宜的方法对供试品宿主蛋白质、宿主细胞和载体DNA、蛋白A及其他工艺相关杂质进行检测”。
USP<130> PROTEIN A QUALITY ATTRIBUTES中提到希望厂家能够在纯化工艺中将脱落的protein A清除,生产工艺也需要进行相应验证。
关于Protein A检测方法和残留限度,2020年版中国药典三部《尼妥珠单抗注射液》3.1.3.3 蛋白质A残留量中提出“用酶联免疫吸附法(通则3429)测定,蛋白质A残留量应不高于蛋白质总量的0.001%”。
目前,基于ELISA的残留检测基本上已被应用于工艺研发和验证过程中以确保在蛋白A亲和层析之后的过程步骤中能够有效去除残留蛋白A。翌圣自主研发的Protein A ELISA Kit正是采用ELISA方法,通过试剂盒中的标准品对样品中的残留protein A进行定量检测。
图6. 翌圣生物ELISA法检测Protein A残留量的实验过程
核酸酶残留检测
在治疗性药物(如抗体、病毒载体药物、疫苗等)的生产及工艺流程中,核酸杂质的去除至关重要。UltraNuclease全能核酸酶,又称为广谱核酸酶、非限制性核酸内切酶,其能够在多种实验条件下切割和降解各种形式的DNA和RNA,广泛用于去除生物制品中的核酸。
在正常的纯化步骤中,全能核酸酶作为杂质很容易被去除。为检测全能核酸酶具体残留量,行业内常采用UltraNuclease作为标准品,开发与之配套的ELISA试剂盒。
翌圣自主研发的UCF.ME® UltraNuclease ELISA Kit正是采用双抗体夹心酶联免疫检测(夹心ELISA)原理,能够准确检测样本中全能核酸酶的残留量,该试剂盒在线性、重复性、回收率及特异性等方面均表现稳定。
图7. 翌圣核酸酶ELISA试剂盒实验原理(双抗夹心ELISA法)
产品信息
|
类别 |
产品 |
货号 |
品名 |
规格 |
|
宿主细胞 残留核酸检测 |
样本前处理 试剂盒 |
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit 磁珠法残留DNA样本前处理试剂盒(瓶装) |
25T/100T |
|
18467ES |
MolPure® Mag48 Sample Preparation Kit FN 磁珠法48孔样本前处理试剂盒FN(预封装) |
3×16T/ 6×16T |
||
|
核酸提取仪器 |
80512ES |
16通道核酸提取仪 |
16通量 |
|
|
80511ES |
48通道自动化核酸提取仪 |
48通量 |
||
|
残留DNA试剂盒 |
41332ES |
CHO Host Cell DNA Residue Detection Kit (3G) CHO宿主细胞DNA残留检测试剂盒(3G) |
50T/100T |
|
|
41307ES |
Vero Host Cell DNA Residue Detection Kit(2G) Vero宿主细胞DNA残留检测试剂盒(2G) |
50T/100T |
||
|
41319ES |
MDCK Host Cell DNA Residue Detection Kit MDCK宿主细胞DNA残留检测试剂盒 |
50T/100T |
||
|
41317ES |
Hansenula polymorpha Host Cell DNA Residue Detection Kit 汉逊酵母宿主细胞DNA残留检测试剂盒 |
50T/100T |
||
|
41324ES |
S. cerevisiae Host Cell DNA Residue Detection Kit 酿酒酵母宿主细胞DNA残留检测试剂盒 |
50T/100T |
||
|
41328ES |
Pichia pastoris Host Cell DNA Residue Detection Kit 毕赤酵母宿主细胞 DNA 残留检测试剂盒 |
50T/100T |
||
|
片段分析试剂盒 |
41334ES |
CHO Host Cell Residue DNA Size Analysis Kit CHO宿主细胞残留DNA片段分析试剂盒 |
4×50T/ 4×100T |
|
|
41314ES |
Vero Host Cell Residue DNA Size Analysis Kit Vero宿主细胞残留DNA片段分析试剂盒 |
4×50T/ 4×100T |
||
|
宿主细胞 残留蛋白检测 |
HCP试剂盒 |
36714ES |
CHO HCP ELISA kit (CHO-K1) CHO HCP ELISA检测试剂盒(CHO-K1) |
48T/96T |
|
36720ES |
Pichia pastoris HCP ELISA Kit 毕赤酵母HCP ELISA检测试剂盒 |
48T/96T |
||
|
BSA残留检测 |
BSA试剂盒 |
36722ES |
BSA ELISA Kit 牛血清白蛋白ELISA检测试剂盒 |
96T |
|
Protein A 残留检测 |
Protein A 试剂盒 |
36716ES |
Protein A ELISA Kit Protein A ELISA检测试剂盒 |
48T/96T |
|
核酸酶残留检测 |
核酸酶ELISA 试剂盒 |
36701ES |
UCF.ME® UltraNuclease ELISA Kit 全能核酸酶检测试剂盒 |
96T |
|
36703ES |
Salt Active UltraNuclease ELISA kit 耐高盐全能核酸酶ELISA试剂盒 |
48T/96T |
||
|
支原体检测 |
支原体qPCR 试剂盒 |
40619ES |
MycAway® Mycoplasma Real-time qPCR Detection Kit (2G) 支原体qPCR检测试剂盒(探针法)(2G) |
25T/100T |
