期刊:Research Article
影响因子:30.083
导语
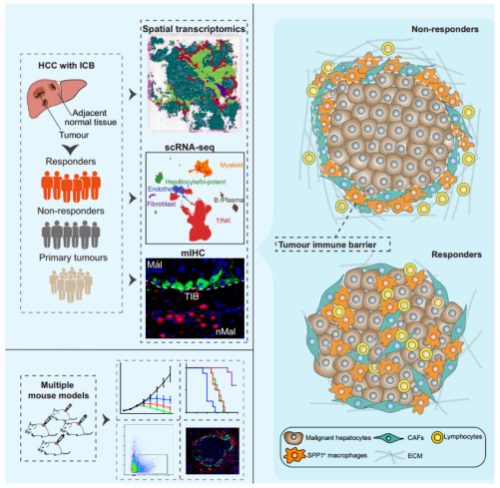
肿瘤微环境(tumor microenvironment, TME)是影响肿瘤进展和治疗结果的重要因素。在多种癌症中,TME亚型与患者对免疫治疗的反应相关。大多数先前的研究都集中在不同细胞成分在TME中与免疫治疗疗效相关的作用。然而,TME的具体结构及其在免疫治疗疗效中的作用在很大程度上仍然未知。本文将空间转录组学与单细胞rna测序和多重免疫荧光相结合,鉴定TME中决定抗pd -1治疗肝细胞癌(HCC)患者免疫治疗效果的特定空间结构。本文发现了一个肿瘤免疫屏障(TIB)结构,一个由SPP1巨噬细胞和癌相关成纤维细胞(CAFs)组成的空间生态位,位于肿瘤边界附近,这与免疫检查点阻断的有效性有关。此外,文章剖析了恶性细胞、SPP1t巨噬细胞和CAFs之间的配体受体网络;即缺氧微环境促进SPP1表达,SPP1巨噬细胞与CAFs相互作用刺激细胞外基质重塑,促进TIB结构形成,从而限制免疫在肿瘤核心的浸润。临床前,阻断小鼠SPP1或巨噬细胞特异性缺失SPP1可增强小鼠肝癌抗pd -1治疗的疗效,同时伴有CAF浸润减少和细胞毒性t细胞浸润增加。文章发现SPP1+巨噬细胞与CAFs相互作用形成的TIB结构与免疫治疗效果有关。因此,通过阻断SPP1破坏TIB结构可能被认为是一种相关的治疗方法,可以增强免疫检查点阻断在HCC中的治疗效果。
科学问题
应用多组学技术鉴定HCC微环境中的TIB(肿瘤免疫屏障)结构。
研究技术
scRNA-Seq、ST、mIHC(多色荧光免疫组化)
研究路线图
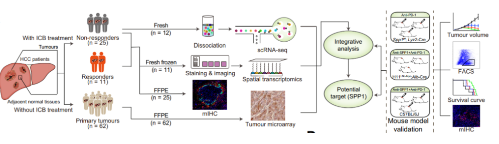
图1
研究结果
1. ST揭示了与免疫治疗效果相关的TIB微环境结构
文章对8例接受抗pd -1治疗的HCC患者的肿瘤切片进行了ST(无应答,n = 5;应答者,n = 3)和邻近正常组织切片(n = 3)。患者#1和#5的肿瘤组织与邻近正常组织配对(图1A)。质量控制后,根据无偏聚类和斑点特征,将邻近正常组织的spot分类为HP和ADH1B高表达的肝细胞、RGS5和MYH11高表达的肌成纤维细胞/周细胞、PTPRC、CD3D、CD79A和COL1A1高表达的免疫/成纤维细胞或FXYD2和KRT7高表达的胆管细胞。肿瘤区域spot分为肝细胞、免疫/成纤维细胞、肌成纤维细胞/周细胞、表达SPP1、CD68、LUM和TIMP1的SPP1+巨噬细胞/CAFs和表达AFP和APOA2的 恶性肝细胞(图2B-G)。
文章发现SPP1+巨噬细胞和CAFS共定位于肿瘤区域周围,在免疫检查点治疗不响应患者中形成一个免疫屏障结构(图2C)。此外,mIHC染色显示,SPP1阳性和aSMA 阳性细胞在肿瘤周围非常接近,ICB无应答者的双阳性细胞对数量明显高于应答者(图2K-L),这表明这两种细胞类型之间的潜在串串有助于形成与免疫治疗效果相关的TIB结构。
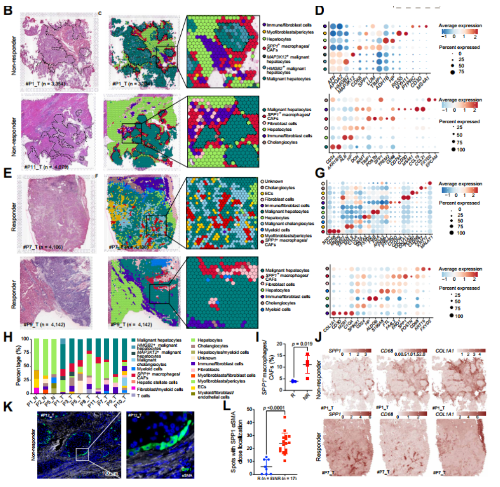
图2
2. 对ICB无响应的HCC配对邻近正常和肿瘤组织的绘制单细胞转录组图谱
为了更好地了解ICB无应答者中TIB的细胞组成,文章对来自6例ICB无应答者的HCC肿瘤和邻近正常组织进行了单细胞转录组测序。质量控制后对剩余83,793 个细胞进行后续分析。基于marker基因共定义出六种主要细胞大类:T/NK细胞、髓系细胞、B/浆细胞、成纤维细胞、内皮细胞和肝细胞/双能细胞(图3A,B)。
在所有患者的肿瘤和邻近正常组织中均可发现六种主要细胞类型(图3C)。其中髓系细胞和成纤维细胞的比例在肿瘤组织中显著增加(图3C)。组织、肿瘤和邻近正常组织之间浸润细胞类型的差异表明,TME的动态重塑在无反应性HCC中起重要作用(图3D-G)。
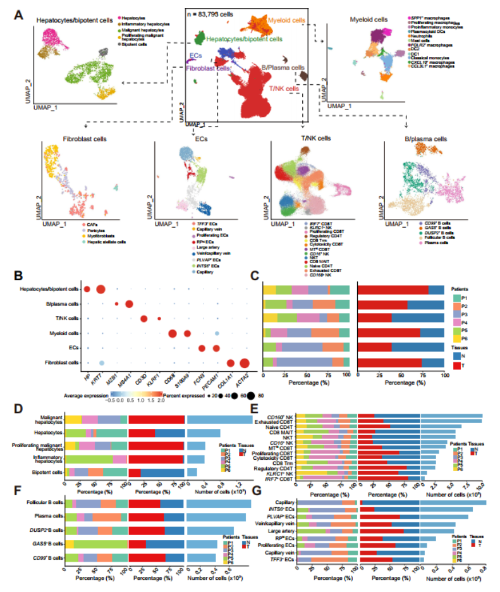
图3
3. 在存在TIB结构的肿瘤区域中SPP1+巨噬细胞显著富集
为了进一步探索存在TIB结构的ICB非响应患者髓系细胞异质性,文章用类型特异性marker将相邻正常组织中的3034个细胞和肿瘤中的7978个细胞分为12个亚型,包括5种表达C1QA和CD68的巨噬细胞亚型(SPP1+巨噬细胞、FOLR2+巨噬细胞、CXCL10+巨噬细胞、CCL3L1+巨噬细胞、增殖型巨噬细胞)、表达CD14的2种单核细胞亚型(经典单核细胞、促炎单核细胞)、表达CSF3R的中性粒细胞、3种DC亚型(DC1、DC2、浆细胞样DCs)和表达TPSB2的肥大细胞(图4A)。
为了验证本文的髓系细胞聚类的准确性,本文将此数据集与Sharma、张泽民等人的数据集进行了整合。SPP1+巨噬细胞与Sharma等人TAM2簇一致,其中SPP1和TREM2表达水平特别高,这些细胞在一定程度上与T细胞相互作用,并与免疫抑制有关。SPP1+巨噬细胞是是张泽民数据集中MJ –C2-C1QA细胞簇。FOLR2+巨噬细胞与Sharma等人的TAM1簇和Zhang等人的MJ -C3-APOE簇相似,与Zhang等人的MJ -C2-C1QA簇重叠。CCL3L1+和CXCL10+巨噬细胞与Sharma等人的单核细胞来源细胞和Zhang等人的MJ - c2 -C1QA簇相似。
携带SPP1的细胞主要分布在TAM2簇,携带FOLR2的细胞位于TAM1簇Sharma等人的数据集。但在Zhang等人的数据集中,SPP1和FOLR2在MJ -C2-C1QA集群中表达,MJ -C2-C1QA集群中表达SPP1和FOLR2的细胞没有重叠,这表明SPP1+巨噬细胞作为一种独立的亚型存在,可能在TME中发挥重要作用。
文章比较了肿瘤和邻近正常组织之间髓系细胞亚型的比例(图4B、C)。SPP1+巨噬细胞的百分比在肿瘤中显著增加(图4C),而浆细胞样DC和DC1簇在邻近正常组织中富集,如先前报道,肿瘤组织中FOLR2+巨噬细胞的比例往往高于邻近正常组织。
4. SPP1+巨噬细胞与肿瘤进展和缺氧微环境有关
为了进一步探究细胞亚型和临床相关性,本文采用CIBERSORTx 在TCGA-LIHC 大队列中评估48中细胞类型的免疫浸润情况,结果发现,在TCGA-LIHC数据集中,与邻近正常组织相比,肿瘤中SPP1+巨噬细胞的浸润明显丰富(图4D)。流式分选结果也显示,无应答者肿瘤组织中SPP1+巨噬细胞浸润明显高于应答者(图4E)。mIHC多重免疫荧光结果也显示CD68与SPP1共定位(图4F)。
值得注意的是,在三个独立的队列中,HCC和SPP1+巨噬细胞浸润较高的患者的总生存期较短(图4G)和TCGA-LIHC队列(唯一可获得无进展生存信息的队列)中较短的无进展生存期,而其他巨噬细胞亚型与患者预后没有显着关联。
文章进一步证实SPP1蛋白在肿瘤组织中特异性表达增加(在邻近正常组织中不表达),并且在HCC肿瘤微阵列中与预后不良有关(图4H-I)。在TCGA-LIHC队列中,SPP1+巨噬细胞的比例在晚期增加(图4J),表明SPP1+巨噬细胞可能促进肿瘤进展。
KEGG富集分析结果显示SPP1+巨噬细胞富集到糖酵解、氧化磷酸化、和HIF-1信号通路,而其他巨噬细胞亚型抗原加工提成被显著富集(图4K)。体外实验显示缺氧可以诱导体外THP-1细胞中SPP1的高表达(图4L),而SPP1+巨噬细胞的吞噬评分最低,这表明SPP1+巨噬细胞确实受到缺氧的影响,促进肿瘤进展,抑制吞噬。
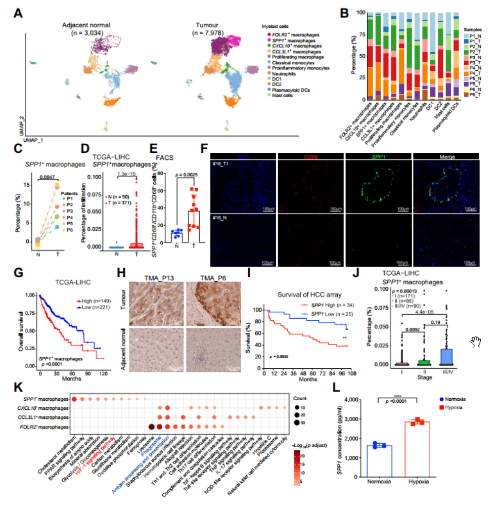
图4
5. CAFs与SPP1+巨噬细胞之间的相互作用与TIB结构的形成有关
为了分析另一种TIB成分CAFs的细胞组成,我们将肿瘤和邻近正常组织的scRNA-seq数据集中的成纤维细胞亚簇分成四种亚型(图5A),包括COL1A1、COL1A2、VCAN和TIMP1表达的CAFs;表达SDO3、DSTN、MYH11和CD9的肌成纤维细胞;周细胞表达RGS5和NDUFA4L2;以及表达COLEC10、CD14和HGF的肝星状细胞。结果发现CAFs主要富集在肿瘤区域(图5B)。CIBERSORTx 结果显示, 与TCGALIHC队列中相邻正常组织相比,肿瘤样本中CAFs的浸润比例显著增加(图5C)。在ICGC HCC队列中,CAFs浸润率较高的患者总体生存期较短(图5D),提示肿瘤组织中CAFs的富集可能与HCC患者预后不良有关。
文章进一步基于单细胞数据中SPP1+巨噬细胞和CAFS top20基因对空间spot 簇进行打分,结果显示CAFs与SPP1+巨噬细胞共定位(图5E-G),打分值也高于其他簇。SPP1+巨噬细胞与CAFS在每个spot点的特征评分呈显著正相关(图5L),这些结果表明SPP1+巨噬细胞和CAFs可能在TIB结构中发生物理相互作用。
SPP1+巨噬细胞/CAFs spot上高表达的基因富集到的通路有助于TIB结构,这些基因在细胞外结构组织、细胞外基质(ECM)组织以及细胞-细胞、细胞底物和细胞-基质粘附中富集(图5M)。
文章进一步通过NicheNet 分析SPP1+巨噬细胞和CAFs细胞通讯情况,结果显示:SPP1+巨噬细胞呈现TGFB1, SPP1和IL1B较高配体活性。TGFB1结合受体TGFBR1、TGFBR2和TGFBR3在CAFs上表达,而SPP1与CAFs上的ITGA4、ITGA9、ITGAV、ITGB1和ITGB5结合, CAFs上IL1B的配体是IL1R1。因此,胶原蛋白(COL1A1, COL1A2, COL3A1,COL4A1和COL5A1),基质金属蛋白酶(TIMP1和MMP)和趋化因子(CCL3、4、5和CXCR4)靶基因在这些细胞中表达。
这些靶点在结缔组织增生反应中发挥重要作用,包括细胞外生态位纤维成分和基质金属蛋白酶,值得注意的是,靶基因的配体与靶之间的相互作用SPP1+巨噬细胞和caf极有可能属于细胞因子-细胞因子受体相互作用,ECM通路、TNF信号通路和IL-17信号通路(图5N)。
然后,文章重点研究了前三种配体(TGFB1、SPP1和IL1B)和ECM相关靶点诱导的信号通路,发现HIF1A和FOXO1等调控子富集于SPP1+巨噬细胞和CAFs的肿瘤组织中。促进ECM形成的靶基因,如TIMP1、LUM、FAP和PSOTN,也在CAFs的肿瘤组织中富集(图5O)。此外,从scRNA-seq数据中获得的SPP1+成纤维细胞前20位配体和CAFs前20位受体的平均表达量在空间集群SPP1+巨噬细胞/ CAFs中高度富集(图5P-Q)。这些结果表明SPP1+巨噬细胞和CAFs紧密地位于TIB中,并通过这些配体受体相互作用促进TIB结构的形成。
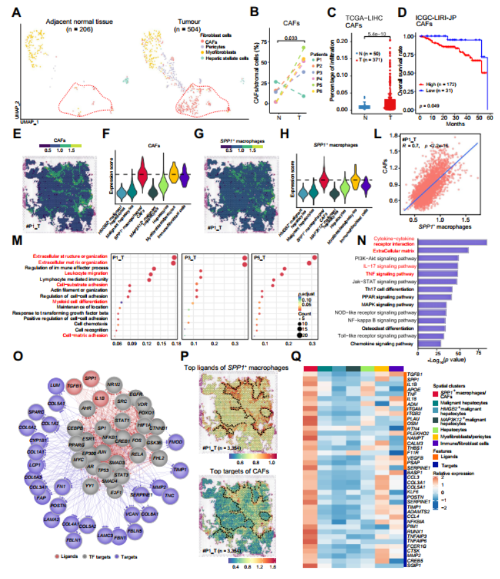
图5
6. TIB结构干扰恶性细胞和免疫细胞之间的相互作用,从而限制对免疫治疗的反应。
进一步看SPP1+ macrophages/CAFs 在TIB结构中重要程度,细胞通讯结果显示,在ICB无应答者中,SPP1+巨噬细胞/CAFs簇与HCC的相互作用权重最强,但与免疫细胞的相互作用较弱,而在应答者中,SPP1+巨噬细胞/CAFs、成纤维细胞和免疫细胞与HCC的相互作用权重相当(图6A、B)。根据对已知免疫特征的分析,在ICB无应答者中,CD8 T淋巴细胞(CD3D和CD8A)和细胞毒性标志物(GZMB、GZMK和PRF1)有限或没有浸润到被TIB结构包围的肿瘤中(图6C),而在没有TIB结构的ICB应答者中观察到免疫细胞浸润(图6D)。
此外,SPP1+巨噬细胞/CAFs的髓系细胞免疫抑制特征和ECM特征的特征评分相对较高(图6E),提示SPP1+巨噬细胞可能与免疫抑制功能有关,CAFs可能与ECM成分的产生有关。为了探索SPP1+巨噬细胞/CAFs在HCC免疫治疗中的功能作用,本文计算了T细胞炎症基因表达谱(GEP)的特征评分,文章发现在TIB包裹的HCC组织中GEP评分较低,并且用于评估GEP评分的基因在TIB包膜的HCC组织中并不丰富(图6F,G)。此外,mIHC染色显示,SPP1+巨噬细胞倾向于定位于肿瘤边界,而CD8+T细胞定位于ICB无应答者的TIB外而不是肿瘤核心(图6H),而应答者的肿瘤中SPP1+巨噬细胞浸润较少,CD8 T细胞浸润较多(图6I)。综上所述,这些结果表明与SPP1+巨噬细胞相关的TIB结构的形成可能有助于HCC的免疫抑制微环境。
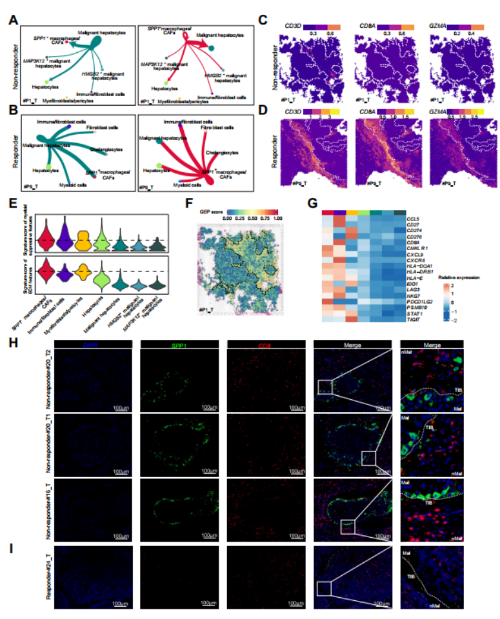
图6
7. 靶向SPP1可以破坏TIB结构并使HCC对免疫治疗敏感
为了进一步验证SPP1的缺失会消除CAFs对免疫微环境的抑制作用,从而使杀伤T细胞浸润肿瘤核心。本文使用单核细胞选择性缺失Spp1的小鼠品系(Spp1fff;Lyz2-Cre)建立肿瘤模型,与Spp1f小鼠相比,抗pd -1治疗Lyz2-Cre小鼠肿瘤生长速度明显下降,治疗效果较好(图7A)。流式细胞术分析显示,抗pd -1治疗显著增加了Spp1肿瘤区域的肿瘤浸润性CD8+T细胞(图7B)和颗粒酶B CD8+T细胞(图7C)的数量;Lyz2-Cre老鼠。mIHC染色结果显示,PD-1后Lyz2-Cre小鼠肿瘤区域CD8+细胞上颗粒酶B染色强度高于其他组(图7D-E)。此外,我们在Hepa 1-6肝肿瘤模型中检测了抗spp1和抗pd -1联合治疗的效果。与SPP1条件敲除小鼠的结果相似,在携带Hepa 1-6肿瘤的免疫正常小鼠中,与单独治疗相比,联合抗SPP1和抗pd -1治疗诱导肿瘤生长减少,显著提高了应答率(图7F)。抗spp1和抗pd -1联合治疗也显著增加了肿瘤区域颗粒酶B和CD8+T细胞的数量(图7G-H)。重要的是,我们发现在SPP1条件敲除组或抗SPP1处理后,aSMAt成纤维细胞的表达下降,抗spp1或抗pd -1治疗略微增加了荷瘤GDL小鼠的总生存期,而抗spp1和抗pd -1联合治疗可显著提高荷瘤GDL小鼠的总生存期(图7I)。此外,抗spp1和抗pd -1联合治疗也显著降低了aSMA+成纤维细胞的比例,增加了肿瘤区域CD8+细胞的比例(图7J)。这些结果表明阻断SPP1可以增强抗pd -1免疫治疗的疗效。因此,SPP1可能作为一种有价值的生物标志物,用于预测需要免疫治疗的HCC患者的预后,而靶向SPP1可能在未来进一步使HCC对免疫检查点抑制剂敏感。
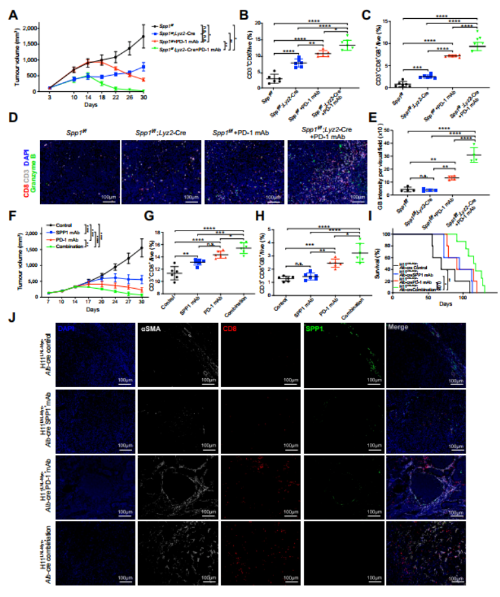
图7
结论
综上所述,本文的研究整合了单细胞和ST数据,以鉴定和表征HCC TME中与免疫治疗疗效相关的TIB结构。文章发现了SPP1+巨噬细胞可作为HCC潜在的临床治疗靶点。阻断这个靶点会破坏TIB并促进CD8+ T细胞向肿瘤的浸润。这种新的治疗策略,可用于破坏细胞间相互作用,并可与免疫检查点抑制剂联合使用,以提高HCC的治疗效果。
参考文献:
Liu Y, Xun Z, Ma K, Liang S, Li X, Zhou S, Sun L, Liu Y, Du Y, Guo X, Cui T, Zhou H, Wang J, Yin D, Song R, Zhang S, Cai W, Meng F, Guo H, Zhang B, Yang D, Bao R, Hu Q, Wang J, Ye Y, Liu L. Identification of a tumour immune barrier in the HCC microenvironment that determines the efficacy of immunotherapy. J Hepatol. 2023 Apr;78(4):770-782. doi: 10.1016/j.jhep.2023.01.011. Epub 2023 Jan 26. PMID: 36708811.
