前 言
获批IND的候选药物在临床前动物模型上表现出很好的药效结果和安全性,但在人体的有效性和安全率却不到10%。导致该结果的原因包括:种属之间的差异、动物模型选择的准确性、动物药效实验的科学性、客观性和准确性等。
相较于细胞系(celllines)、基因工程鼠(genetically engineered mouse models, GEMMs)和人源化异种移植鼠(patient-derived xenografts, PDX)这些传统的研究模型,类器官模型(鼠源类器官mouse-derived organoids, MDO)和人源类器官patient-derived organoids,PDO)不但能够取自正常组织和组织癌变过程中各个阶段的肿瘤组织,而且其培养体系简单易操作,时间和金钱成本较低,且具有较高效率,因而得到广大研究人员的青睐,被Nature Methods评为2017年生命科学领域年度技术。

01
类器官研究领域
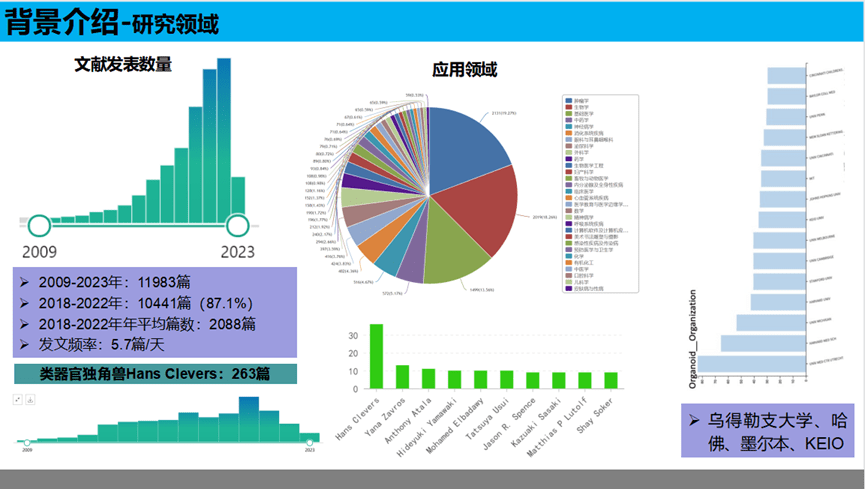
自2009年Hans Clevers教授报道了第一例类器官,共有11983篇关于类器官的研究论文发表(数据来源于PubMed),研究领域主要涉及肿瘤学和生物学,近4年来(2018-2022年),共发表10441篇论文发表,占整体发文量的87.1%。作为类器官领域的“独角兽”Hans Clevers,共有263篇论文发表,部分论文发表在Nature、Cell等期刊。
02
类器官简介
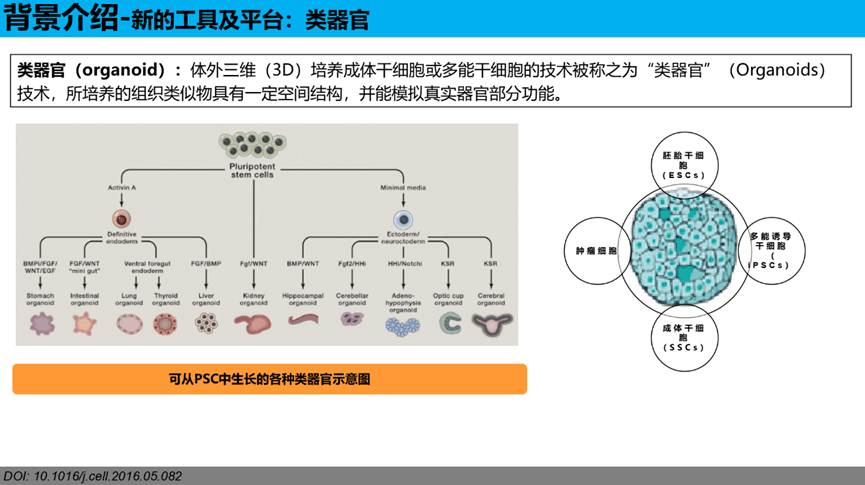
类器官(organoid):体外三维(3D)培养成体干细胞或多能干细胞的技术被称之为“类器官”(Organoids)技术,所培养的组织类似物具有一定空间结构,并能模拟真实器官部分功能。主要来源于胚胎干细胞、多功能诱导干细胞、成体干细胞及肿瘤干细胞。
03
类器官培养及构建
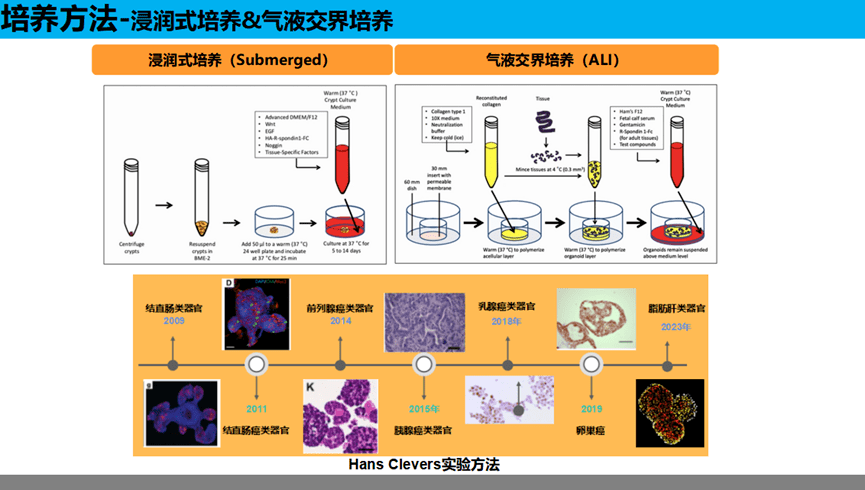
类器官培养方式主要分为2类:浸润式培养和气液交界培养。
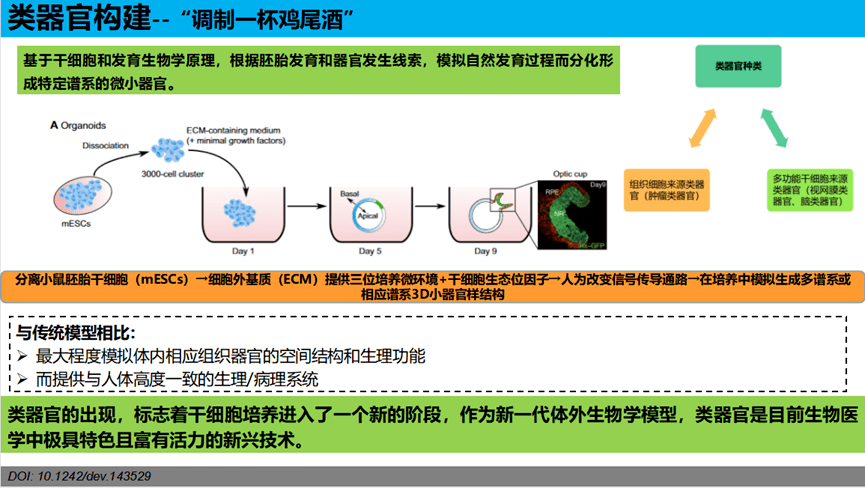
类器官的构建就像是在调制一杯“鸡尾酒”。其主要原理是基于干细胞和发育生物学原理,根据胚胎发育和器官发生线索,模拟自然发育过程而分化形成特定谱系的微小器官。与传统模型相比:最大程度模拟体内相应组织器官的空间结构和生理功能,而提供与人体高度一致的生理/病理系统。
以小肠类器官为例,2007年,Hans Clevers实验室就通过lineage tracing实验(细胞谱系示踪技术)发现小肠和结肠的干细胞为Lgr5+细胞。2009年,荷兰科学家Hans Clevers的团队成功地在体外将Lgr5+肠道干细胞培养成包括隐窝样区域和绒毛样上皮区域的三维结构,即小肠类器官。这一结构包含所有终末分化细胞类型,能准确模拟肠道上皮生理情况,这一方法的建立既实现了肠上皮长期体外培养又可以维持肠上皮细胞原始分化能力,该技术已经逐渐被应用于干细胞、疾病模型以及再生药物等相关研究。小肠类器官的培养可以通过多能诱导干细胞或胚胎干细胞来诱导分化,也可以取小肠的隐窝干细胞来诱导分化。目前大多数研究都是采用小肠隐窝干细胞来培养,因为该方法不仅获取干细胞方便,对技术的要求不高,而且培养的类器官传代次数更多,可以在体外长期培养长达2个月之久。具体培养方式见ppt原文。

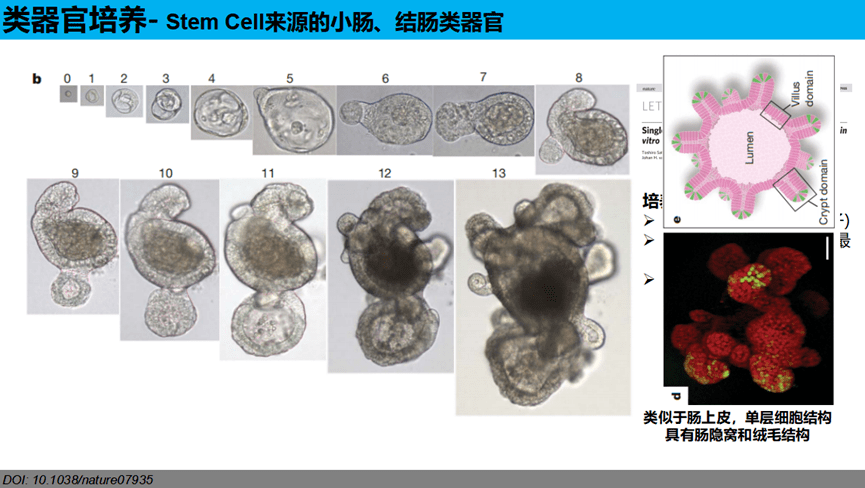
04
类器官种类
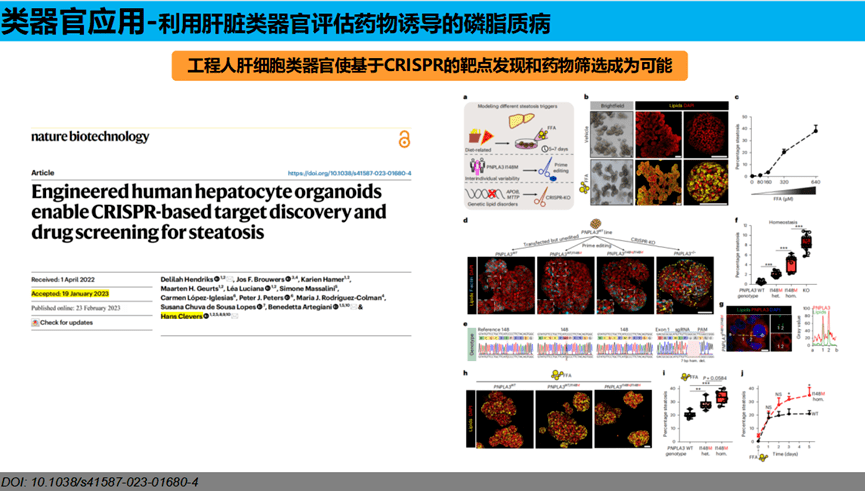
类器官培养已应用于各种器官,包括:大脑(brain)、视杯(Optic Cup)、内耳(Inner Ear)、肺(lung)、肝(liver)、结肠(Colon)、肾(Kidney)、胰腺(Pancreatic)、前列腺(Prostate)、胃(Gastroids)、乳腺(galactophore),2023年1月,Hans Clevers团队构建出非酒精性脂肪肝类器官模型,工程人肝细胞类器官使基于CRISPR的靶点发现和药物筛选成为可能。
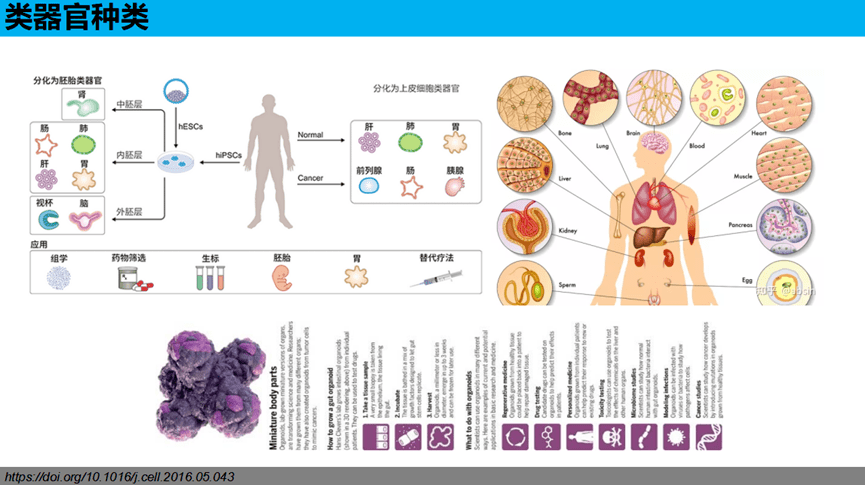
05
类器官应用
类器官应用领域广阔:类器官作为体外模型,在疾病发生机理、新靶点发现、诊疗新策略探索、药敏检测、新药研发、再生医学等多方向拥有广泛的应用前景。其中肝类器官已被应用于药物疗效毒性以及辅助患者建立个体化治疗方案等。我们以“利用肝脏类器官预测药物诱导的磷脂质病”为例,介绍类器官的应用。

PL诱导剂:阿米卡星、盐酸胺碘酮、盐酸舍曲林和对乙酰氨基酚。阿米卡星、胺碘酮和舍曲林分别是弱、中度和强的PL诱导药物。对乙酰氨基酚作为诱导PL的阴性对照药物。
类器官培养:单个患者的人肝组织(0.5-1cm3)从首尔峨山医疗中心进行的肝切除术中获得。手术切除后,组织在汉克斯平衡盐溶液(HBSS)中保持在4℃,直到处理。参考前期文献:组织用无菌剪刀切碎,用胶原酶D和Dnase I在无菌Earle平衡盐溶液(EBSS)培养基中中消化。将分离的导管细胞与基质凝胶或还原生长因子BME 2(基底膜提取物)混合,每孔5000-10000个细胞接种于24孔板中。基质凝胶或BME固化后,每孔加入500µL培养基。基础培养基:DMEM/F12,并包括各种补充剂。前3天,培养基中添加25 ng/mL重组人肝素、100 ng/mL Wnt3a和10µM Y27632分离导管细胞。然后用不含Noggin、Wnt3a或Y27632代替。在单个导管细胞变成一个类器官后,每5-7天以1:2-1:4的分裂比例进行传代。在37℃的含有5%二氧化碳的潮湿气氛中培养。

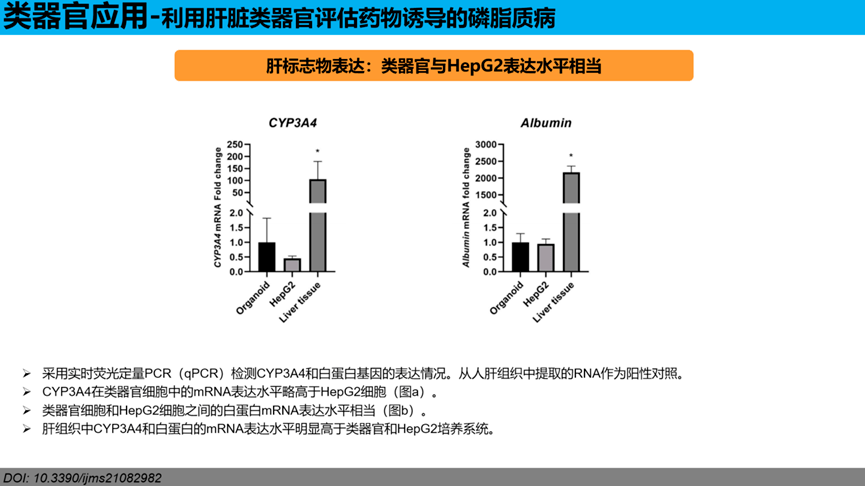
肝标志物表达:类器官与HepG2表达水平相当。采用实时荧光定量PCR(qPCR)检测CYP3A4和白蛋白基因的表达情况。从人肝组织中提取的RNA作为阳性对照。CYP3A4在类器官细胞中的mRNA表达水平略高于HepG2细胞(图a)。类器官细胞和HepG2细胞之间的白蛋白mRNA表达水平相当(图b)。肝组织中CYP3A4和白蛋白的mRNA表达水平明显高于类器官和HepG2培养系统。
糖原积累:采用PAS染色法检测人肝类器官、HepG2细胞和人肝组织中糖原的积累情况。类器官呈明显的阳性糖原染色,呈强烈的洋红色。HepG2细胞的染色不如类器官细胞清晰。类器官细胞的细胞质中含有多糖或糖原、糖蛋白、糖脂等多糖或粘液物质,如图所示。
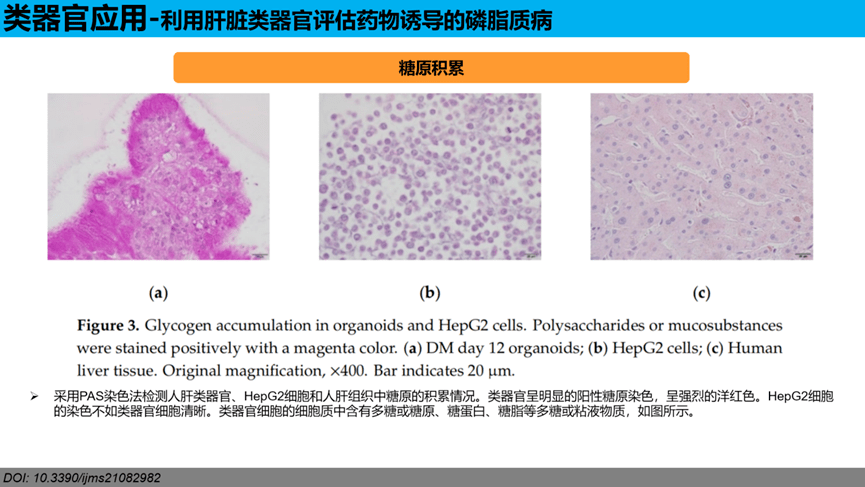
蛋白表达:肝脏转录因子HNF4α在类器官中表达比HepG2强很多。用免疫荧光法在两种培养系统中均可检测到肝蛋白HNF4α。如图a-c所示,人肝类器官蛋白呈阳性(绿色),强于HepG2细胞。在HepG2细胞的胞浆中呈非特异性阳性染色。通过免疫组化方法观察了两种培养系统中CYP3A4和CYP1A2的表达。如图d-f所示,CYP3A4在人肝类器官中的表达比在HepG2细胞中更明显。CYP1A2在两种肝细胞培养中均明显表达阳性(图g-i)。
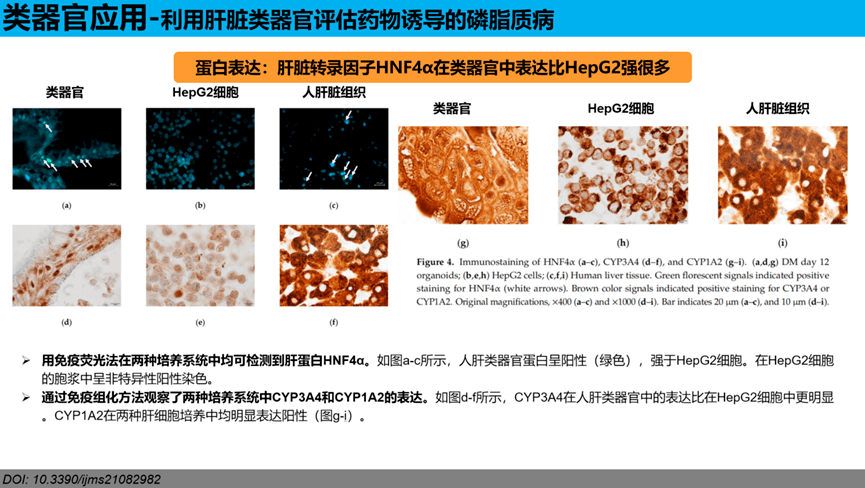
细胞活力测试:在培养48小时后,当暴露于高剂量的PL诱导药物时,人肝脏类器官比HepG2细胞存活得更好。各PL药物组的类器官和HepG2细胞的活力均发生了显著变化。2D和3D培养的肝细胞均暴露于舍曲林。在20µM剂量的胺碘酮和舍曲林作用下,HepG2细胞的单层细胞显示出明显的细胞死亡,而在这些药物浓度下,类器官的活性更高。对乙酰氨基酚在25µM或50µM水平下使用,在两种培养系统中均未引起显著的细胞活力变化。
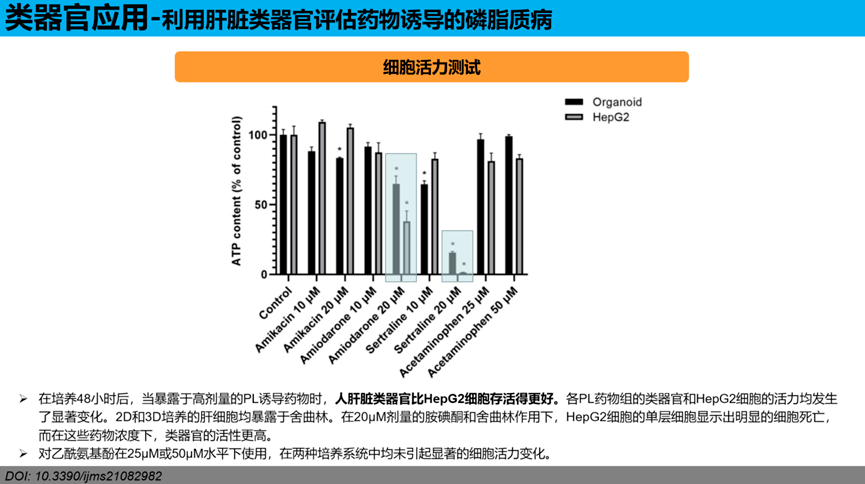
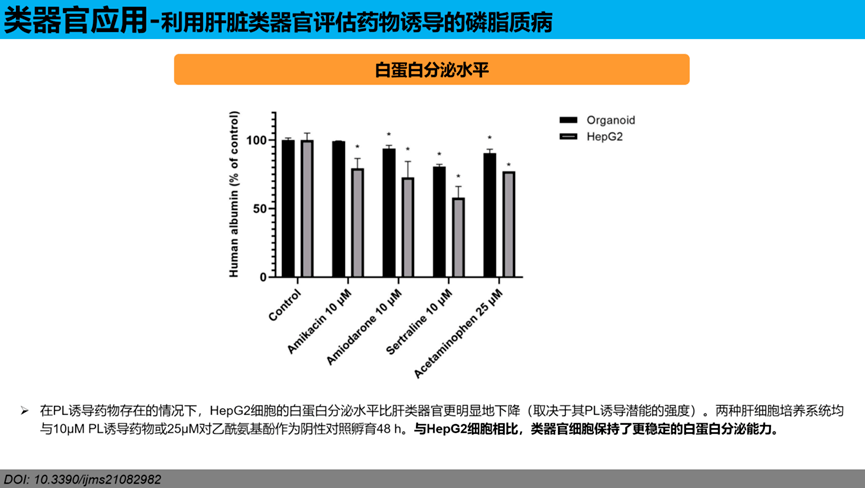
白蛋白分泌水平:在PL诱导药物存在的情况下,HepG2细胞的白蛋白分泌水平比肝类器官更明显地下降(取决于其PL诱导潜能的强度)。两种肝细胞培养系统均与10µM PL诱导药物或25µM对乙酰氨基酚作为阴性对照孵育48 h。与HepG2细胞相比,类器官细胞保持了更稳定的白蛋白分泌能力。
形态学变化:为了评估PL导致的类器官和HepG2细胞培养系统的形态学变化,细胞用10µM的指示药物或25µM的对乙酰氨基酚处理48小时,H&E染色。如图所示,在两种培养系统中,具有较高的PL诱导能力的药物均可导致较高的细胞质液泡量。虽然这些液泡变化认为是药物诱导的PL的结果,但这些由这种情况引起的空泡化实体类似于光镜下组织载玻片处理过程中产生的脂质积累或伪影。
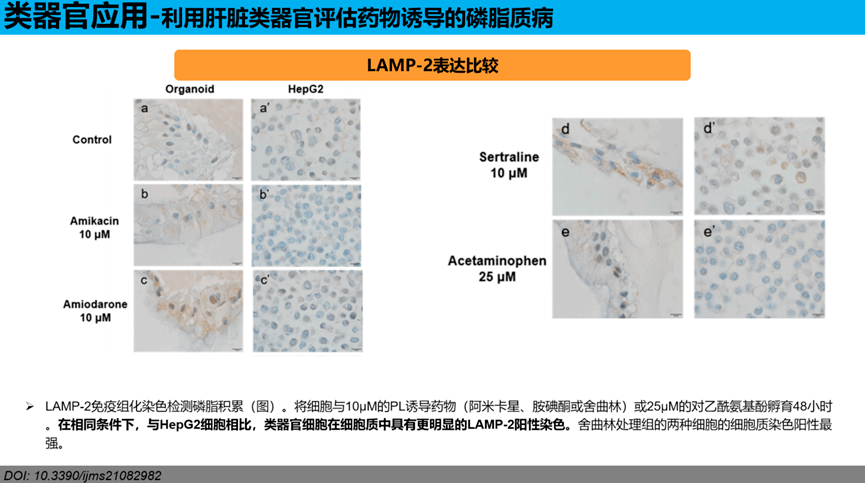
LAMP-2表达比较:LAMP-2免疫组化染色检测磷脂积累(图)。将细胞与10µM的PL诱导药物(阿米卡星、胺碘酮或舍曲林)或25µM的对乙酰氨基酚孵育48小时。在相同条件下,与HepG2细胞相比,类器官细胞在细胞质中具有更明显的LAMP-2阳性染色。舍曲林处理组的两种细胞的细胞质染色阳性最强。
PL证实:用透射电镜证实了药物诱导的肝脏类器官磷脂病(图)。10µM胺碘酮处理48h后,类器官产生明显的层状体。
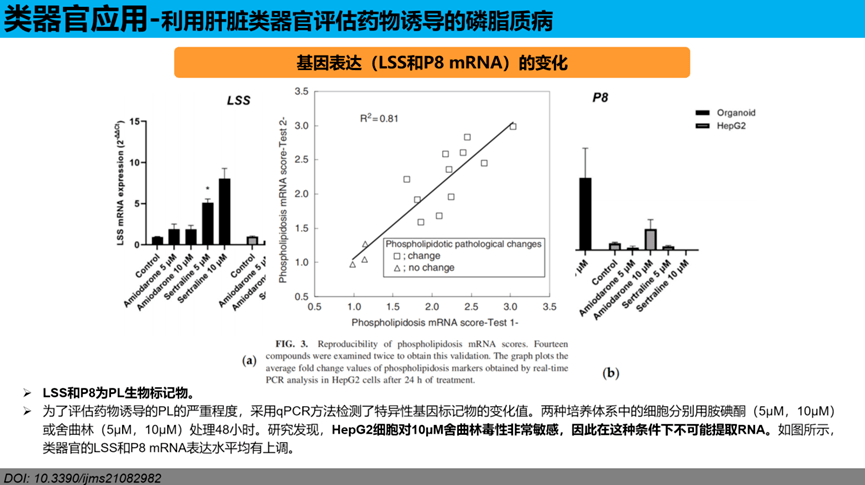
基因表达(LSS和P8 mRNA)的变化:LSS和P8为PL生物标记物。为了评估药物诱导的PL的严重程度,采用qPCR方法检测了特异性基因标记物的变化值。两种培养体系中的细胞分别用胺碘酮(5µM,10µM)或舍曲林(5µM,10µM)处理48小时。研究发现,HepG2细胞对10µM舍曲林毒性非常敏感,因此在这种条件下不可能提取RNA。如图所示,类器官的LSS和P8 mRNA表达水平均有上调。
06
类器官面临的挑战
成本:类器官作为新型的药筛模型,成本虽然较PDX更低,但还是高于细胞系。类器官成本占比较高的包括培养使用的基质胶。
目前大多类器官本身并不具备血管化的结构。因此,随着类器官体积的增长,类器官受限于氧气的缺失以及代谢废物的增加,可能导致的组织坏死。已有研究构建血管内皮细胞微环境的肿瘤类器官,将类器官肿瘤细胞和血管内皮细胞在Matrigel上共同培养,生成血管结构以期解决类器官血管化缺失的问题。

血管化以外的难点还包括模拟肿瘤和免疫环境的相互作用关系。2019年Nature Protocol期刊发表了肿瘤类器官和免疫细胞共同培养的相关protocol,可以体现和模拟出肿瘤微环境的部分特征。以上皮类器官和免疫细胞共培养模型为例,可通过在培养基中添加活化的免疫细胞、在组织消化成单细胞后和免疫细胞共同生长、添加ECM中的重组细胞因子等方法重塑类器官和免疫细胞的相互作用。
相比于单个类器官,类器官系统的构建能够对药物疗效和潜在毒性做出更完整全面的评估。目前类器官仅能检测出药物对于肿瘤的抑制效果,对于其他器官组织是否存在其他副作用和安全性风险并不能做出预判。

Clevers H. Modeling Development and Disease with Organoids. Cell. 2016 Jun 16;165(7):1586-1597. doi: 10.1016/j.cell.2016.05.082. PMID: 27315476.
Simunovic M, Brivanlou AH. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 2017 Mar 15;144(6):976-985. doi: 10.1242/dev.143529. PMID: 28292844; PMCID: PMC5358114.
Sato T, Vries RG, Snippert HJ, van de Wetering M, Barker N, Stange DE, van Es JH, Abo A, Kujala P, Peters PJ, Clevers H. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5. doi: 10.1038/nature07935. Epub 2009 Mar 29. PMID: 19329995.
Sahu S, Sharan SK. Translating Embryogenesis to Generate Organoids: Novel Approaches to Personalized Medicine. iScience. 2020 Sep 25;23(9):101485. doi:
Lee JY, Han HJ, Lee SJ, Cho EH, Lee HB, Seok JH, Lim HS, Son WC. Use of 3D Human Liver Organoids to Predict Drug-Induced Phospholipidosis. Int J Mol Sci. 2020 Apr 23;21(8):2982. doi: 10.3390/ijms21082982. PMID: 32340283; PMCID: PMC7216064
